Pilhas e baterias
Uma pilha ou bateria é um dispositivo que transforma energia química em energia eléctrica. A pilha tem três partes: os electrodos, o electrólito e o recipiente.
Os electrodos são os condutores de corrente da pilha.
O electrólito é a solução que age sobre os electrodos.
O recipiente guarda o electrólito e suporta os electrodos.
Existem dois tipos básicos de pilhas.
A pilha primária é uma pilha na qual a reacção química acaba por destruir um dos electrodos, normalmente o negativo. A pilha primária não pode ser recarregada.
A pilha secundária é uma pilha na qual as acções químicas alteram os electrodos e o electrólito. Os electrodos e o electrólito podem ser restaurados à sua condição original pela recarga da pilha.
Acção Electroquímica é o processo de conversão de energia química em energia eléctrica.
O ânodo é o electrodo positivo de uma pilha.
O cátodo é o electrodo negativo de uma pilha.
Capacidade de uma bateria
A capacidade de uma bateria define a sua a capacidade energética é expressa em ampère-hora (1 A·h = 3600 coulombs). Se uma bateria debita um ampère (1 A) de corrente (fluxo) por uma hora, tem uma capacidade de 1 A·h. Se puder fornecer 1 A por 10 horas, sua capacidade é 10 A·h.
Baterias Alcalinas
As pilhas alcalinas são as usadas normalmente em lanternas, rádios, etc…
Vantagens: custo baixo, são vulgares podem-se encontrar com facilidade em qualquer lugar, durabilidade e potencia elevada para seu tamanho/peso.
Desvantagens: a grande maioria dos modelos comercializados não pode ser recarregada e geralmente é necessária a utilização de suportes para utilização nos diversos dispositivos.
Baterias de Chumbo
As Baterias chumbo-ácido foram inventadas no Séc. XIX, tem como componentes básicos o chumbo ou óxido de chumbo e o ácido sulfúrico.
Vantagens: custo relativamente baixo, resistência a grandes variações de temperatura e grande durabilidade.
Desvantagens: pesada, demora bastante tempo a ser carregada, descarrega-se rapidamente, sofre uma diminuição (pequena, mas constante) de voltagem durante sua utilização e não pode ser recarregada totalmente com tanta frequência como os outros tipos. A sua melhor utilização é esporádica, uma vez que este tipo de bateria é desenhado para ser constantemente carregada e eventualmente descarregada (ex.: é o tipo utilizado em automóveis, sendo carregada com o motor em funcionamento e descarrega nos arrancas ou no funcionamento de dispositivos com o veiculo desligado).
Lítio
A pilha de Lítio popularizou-se com o aparecimento de micro circuitos electrónicos utilizados em relógios, jogos, etc…
Vantagens: destaca-se entre os demais tipos por descarregar-se muito lentamente quando armazenada carregada (em média 10% ao mês), e pelo tempo de recarga baixo. Entre todos os outros tipos, são as mais leves. Oferecem cerca do dobro da capacidade de uma bateria do tipo NiMH com o mesmo tamanho. O tempo de recarga também é o mais rápido quando comparado aos demais tipos.
Desvantagens: custo elevado.
Níquel-cádmio (NiCd)

A bateria de níquel-cádmio (NiCd) foi inventada no Séc.XX.
Vantagens: potencial energético maior do que o da de chumbo-ácido, o que faz com que seja de 20 a 50% mais leve, proporcionando um tempo de utilização superior para o mesmo peso. Não sofre queda de voltagem durante a utilização.
Desvantagens: custo mais alto do que o da de chumbo-ácido, é muito tóxica para o meio ambiente (devido ao cádmio). Além disto, este tipo de bateria sofre mais com extremos de temperatura, descarregando-se muito rapidamente em temperaturas muito baixas e não se carregando totalmente em temperaturas muito elevadas.
Níquel Hidreto Metálico (NiMH)

A bateria de níquel-metal-hidreto (NiMH) possui algumas vantagens em relação aos outros tipos: resiste a um número maior de cargas/descargas na sua vida útil do que as de NiCad, possuindo um potencial energético ligeiramente superior (20% em média); ainda em comparação com as de NiCd, possui custo apenas ligeiramente superior, tempo de recarga inferior e maior resistência a variações de temperatura. Tem praticamente o mesmo peso que as de NiCd. Ambientalmente é mais amigável do que a de NiCD.
Desvantagem: custo superior ao das de níquel-cádmio.
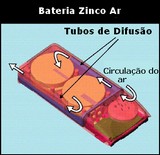
Zinco Ar
As pilhas de zinco-ar são a mais recente tecnologia desenvolvida para o armazenamento de energia. Este tipo de bateria funciona extraindo o oxigénio existente no ar para reagir com o zinco e produzir electricidade. Seu princípio de funcionamento é semelhante ao das baterias alcalinas, que também possui zinco no seu interior reagindo com o oxigénio para produzir energia. Porém, nestas baterias o oxigénio é fornecido por um componente interno (dióxido de manganês), nas baterias do tipo zinco-ar , o oxigénio vem da atmosfera, a bateria tem várias aberturas.
Existem dois tipos de baterias zinco-ar: as que podem ser recarregadas e as descartáveis. Baterias deste tipo recarregáveis (onde células de zinco são substituídas) são utilizadas em aplicações como veículos eléctricos movidos a bateria. A grande vantagem deste tipo de bateria é sua durabilidade (tempo de descarga), muito maior do que a dos outros tipos até hoje existentes.
Baterias de Gel
As baterias de gel substituem as baterias de chumbo permitindo uma vida útil mais prolongada. Basicamente não têm evaporação electrolítica e suas consequências, como acontece com as baterias ácidas. Existem baterias de reduzidas dimensões especialmente concebidas para aplicações RFID.
Vantagens – Não têm evaporação electrolítica, maior resistência a temperatura elevadas, choque e vibração.
Desvantagens – Preço mais elevado do que as baterias de chumbo.